- トップページ
- 製品の選び方
- 緩衝液(バッファー)ライブラリ
- 緩衝液(バッファー)の基礎知識
緩衝液(バッファー)の基礎知識
目次
緩衝液(バッファー)とは
緩衝液(バッファー)とは、pHの変化を和らげる溶液のことです。少量の酸や塩基を加えた際、その影響を緩和しpHをほぼ一定に保つ働き(緩衝作用)を持っています。
緩衝液は一般的に、弱酸とその塩(共役塩基)、または弱塩基とその塩(共役酸)を混合することでつくられます。
ライフサイエンス分野における緩衝液
生命を維持するには、生体内のpHを弱アルカリ性(pH7.40±0.05)に保つ必要があり、細胞内液や血漿も緩衝液として働いています。
健康なヒトの血液は、炭酸イオン(CO32-)と炭酸水素イオン(HCO3-)でpH 7.40に保たれています。
また細胞内でも、リン酸水素イオン(HPO42-)とリン酸二水素イオン(H2PO4-)が緩衝物質として作用しており、生体内は常にpH7.40±0.05になるように作用しています。
そのため、ライフサイエンス分野の実験において緩衝液は、生体内に近いpH環境を作り出すことでpHの急激な変化を抑えるという非常に重要な役割を担っています。
緩衝液(バッファー)の原理
緩衝液に酸や塩基を加えても、pHの変化を抑えることができる原理を酢酸緩衝液を例に解説します。
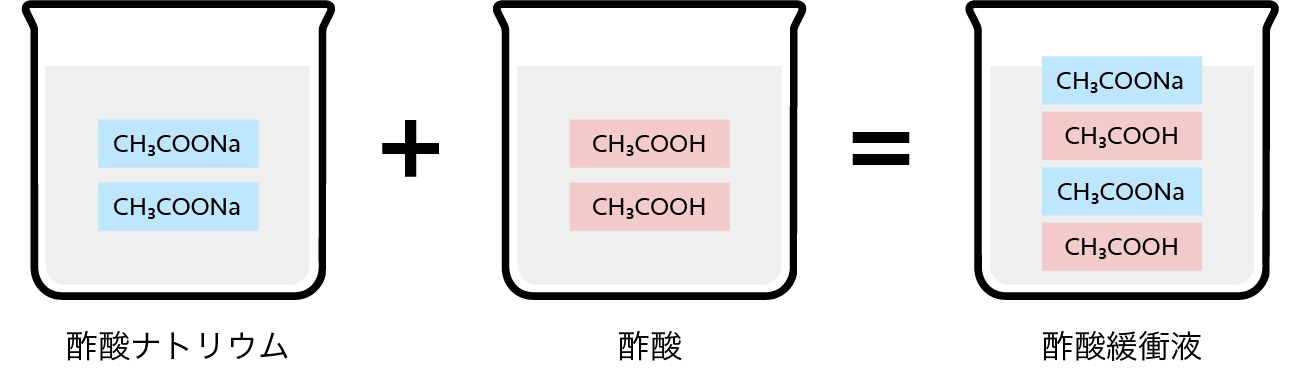
1. 酢酸緩衝液の電離状態
酢酸緩衝液には、酢酸(CH3COOH)と酢酸ナトリウム(CH3COONa)が混在しています。
酢酸、酢酸ナトリウムはそれぞれ水溶液中で電離しますが、電離のしやすさは物質によって異なります。
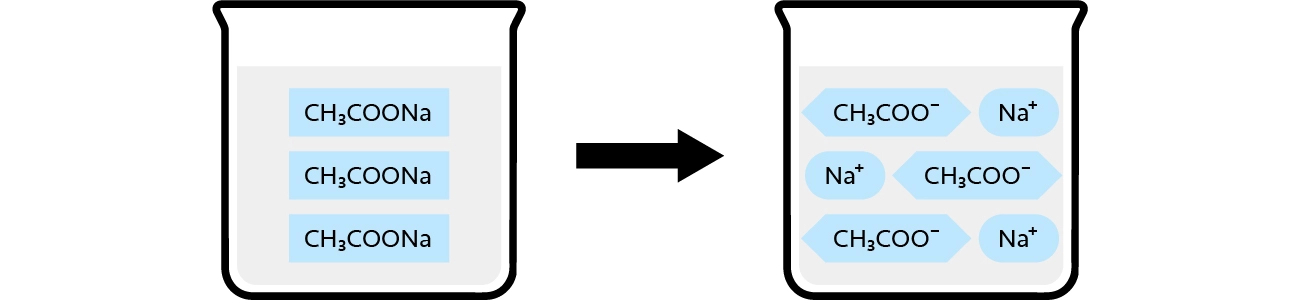
酢酸ナトリウム電離の様子(電離しやすい)
酢酸ナトリウムは、酢酸(弱酸)とナトリウム(強塩基)からなる塩で、水溶液中では完全に電離しています。
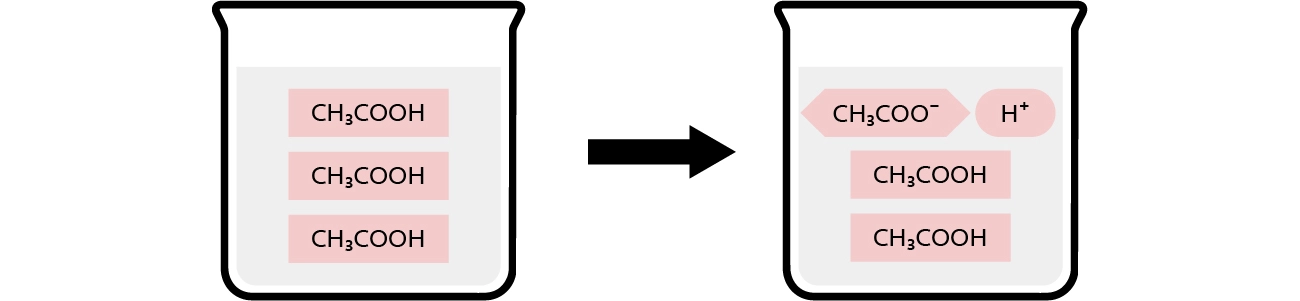
酢酸電離の様子(電離しにくい)
酢酸は弱酸のため水溶液中でごく一部しか電離せず、平衡は左側(酢酸側)に偏っています。
酢酸ナトリウムが混在する場合には、酢酸ナトリウムの電離で発生した酢酸イオン(CH3COO- )の影響で、酢酸の電離がさらに抑制されます。
このように、イオンを含む溶液に同じイオンを放出する物質を加えて平衡が移動することを共通イオン効果といいます。
酢酸緩衝液全体の様子
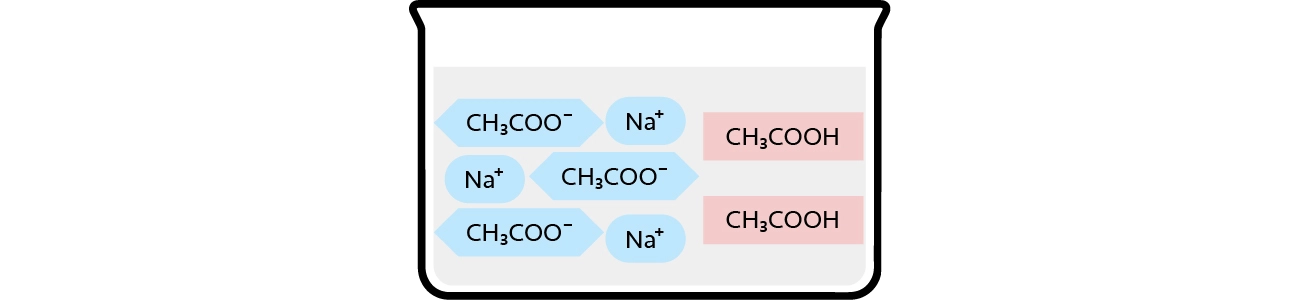
酢酸緩衝液では、酢酸ナトリウムの電離、酢酸の電離が1つの溶液中で起きています。
酢酸ナトリウムは完全に電離して酢酸イオンとナトリウムイオンになります。
一方、酢酸は電離しにくいため、ほぼ酢酸のまま(=H+が発生しない)です。
そのため、水溶液中に主に存在する分子は酢酸イオン(CH3COO- )、ナトリウムイオン(Na+)、酢酸(CH3COOH)の3つとみなすことができます。
※酢酸ナトリウム(CH3COONa)と酸(H+)はほぼ存在しないものとして考えられます。
ここに、pHの変動をもたらす酸(H+)や塩基(OH- )を加えると、緩衝液が効果を発揮します。
2. 緩衝液のメカニズム
緩衝液は、酸や塩基を加えても、対応するイオンとの反応によってpHの変化が抑えられます。この作用は、酸や塩基と対をなすイオンを消費しきるまで続きます。
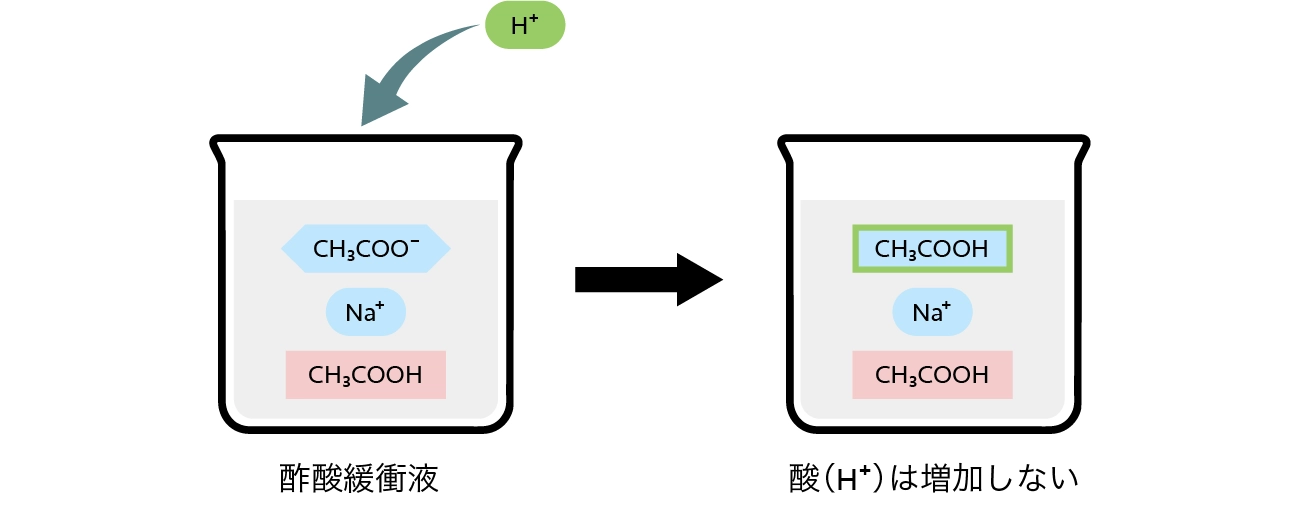
酸(H+)による平衡移動(ルシャトリエの原理)
溶液などの平衡状態に外部要因(圧力、温度、濃度など)による変化があった際、変化を抑える方向に平衡が移動することをルシャトリエの原理といいます。
酸(H+)を加えても、ルシャトリエの原理によって酢酸イオンと反応するため、酢酸イオンが存在する限り酸(H+)は増加しません。(=pHが変化しない)
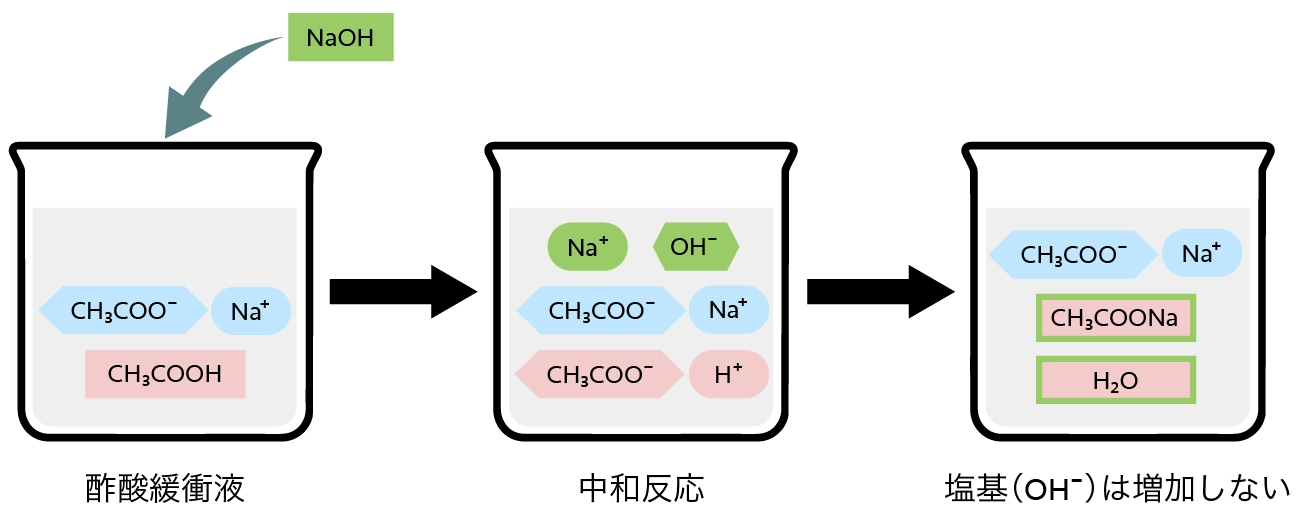
塩基(OH- )による中和反応
水酸化ナトリウム(NaOH)などの塩基を溶液中に加えると、中和反応が起きて水酸化物イオンが消費されます。(=pHが変化しない)
緩衝液(バッファー)を選ぶ際のポイント
緩衝液の性質によって、緩衝液に含まれる物質が研究や分析の妨げになったり、サンプルとの相互作用により悪影響を及ぼす可能性があります。
そのため、実験に使用するサンプルや実験の工程によって最適な緩衝液を選定する必要があります。
pHとpKa
緩衝液のpHとその中に含まれている緩衝作用を発揮する物質(酸や塩基)のpKaが、pH=pKa±1の範囲のときに緩衝作用をもち、pH=pKaのときに緩衝作用が最も大きくなります。
使用したい緩衝液のpHに近いpKaを持つ酸や塩基を緩衝物質として選ぶことで、緩衝作用を最大限に活かすことができます。
PointpKaについて
pKaとは、酸性の強さを表す指標です。物質とその物質の温度条件などで値が決まり、強酸であるほど値は小さくなります。
pKaがpHと等しいとき(pKa=pH)、酸の50%が解離している状態です。
化学的性質
水素イオンなどの放出は、溶液の変性を招きます。
必要以上に高濃度の緩衝液を使用せず、錯体や沈殿を生成しにくい物質を選ぶ必要があります。
また、酵素反応などを妨害しないか、カビや細菌に対して栄養塩になるか、殺菌作用を示すかなども考慮する必要があります。
Point溶液の変性例
りん酸イオン:2価、3価の陽イオン(アルカリ金属イオンなど)により不溶性の塩が生成される
クエン酸:金属イオンと錯体を作り、フリーの金属イオンの濃度を低下させる
吸光スペクトル
分光分析を用いた実験では、緩衝液が測定結果に影響しないように可視・紫外領域の吸光を持たず、溶液に不純物が含まれない緩衝液を選ぶ必要があります。
また、プラスチック容器は紫外部に吸光のある可塑剤が微量に溶け出すことがあり、長期保存には適しません。特に、蛍光スペクトルを測定する場合には注意が必要です。